Fondamenti del Microbiota Intestinale
Il microbiota intestinale: un ecosistema complesso
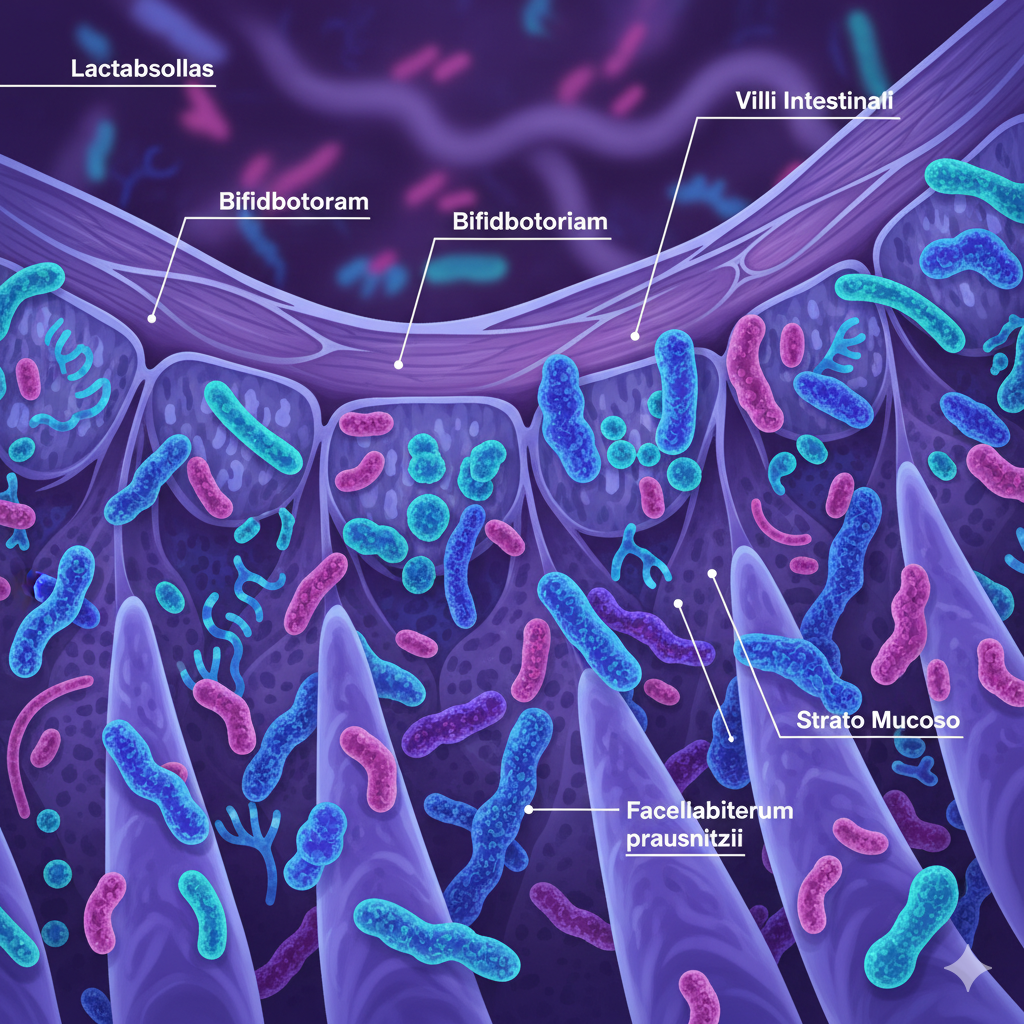
Il microbiota intestinale rappresenta una comunità ecologica straordinariamente complessa che colonizza il tratto gastrointestinale umano. Questo ecosistema ospita approssimativamente 100 trilioni di microrganismi appartenenti a oltre 1000 specie batteriche diverse, superando numericamente le cellule umane in rapporto 10:1. La densità microbica incrementa progressivamente lungo il tratto digestivo, raggiungendo concentrazioni massimali nel colon dove possono risiedere 10¹¹-10¹² cellule batteriche per grammo di contenuto intestinale. La composizione del microbiota varia sostanzialmente tra individui, influenzata da fattori genetici, modalità di nascita, allattamento, dieta, geografia, età e uso di farmaci. Nonostante questa variabilità interindividuale, alcuni phyla dominano universalmente: Bacteroidetes e Firmicutes costituiscono circa 90% della popolazione microbica totale, seguiti da Actinobacteria, Proteobacteria e Verrucomicrobia. Il microbiota non è entità statica ma ecosistema dinamico che risponde rapidamente a perturbazioni ambientali, dietetiche e farmacologiche. La sua composizione si stabilizza relativamente intorno ai 3 anni di età ma mantiene plasticità per tutta la vita. Questa comunità microbica ha co-evoluto con l'ospite umano per millenni, sviluppando relazioni simbiotiche che influenzano profondamente fisiologia, metabolismo, immunità e persino funzioni cerebrali attraverso l'asse microbiota-intestino-cervello.
Funzioni fisiologiche del microbiota
Il microbiota intestinale esercita funzioni molteplici e interconnesse che si rivelano essenziali per la salute dell'ospite. La funzione metabolica include fermentazione di carboidrati complessi non digeribili (fibre alimentari) con produzione di acidi grassi a catena corta (SCFA) – principalmente acetato, propionato e butirrato. Questi metaboliti fungono da substrato energetico per colonociti, modulano pH colico inibendo patogeni, regolano espressione genica e metabolismo lipidico-glucidico sistemico. Il microbiota sintetizza vitamine essenziali come vitamina K, biotina, acido folico e alcune vitamine del gruppo B. Metabolizza composti xenobiotici, farmaci e fitochimici alimentari, modificandone biodisponibilità ed effetti biologici. La funzione barriera previene colonizzazione da parte di patogeni attraverso competizione per nutrienti e siti di adesione, produzione di batteriocine antimicrobiche, acidificazione del lume intestinale. Il microbiota mantiene integrità della barriera epiteliale stimolando produzione di mucina e proteine tight junction. La funzione immunomodulante rappresenta probabilmente il ruolo più critico: il microbiota educa e regola il sistema immunitario, promuovendo tolleranza immunologica verso antigeni alimentari e commensali mentre mantiene capacità di risposta verso patogeni reali. Stimola maturazione del tessuto linfoide associato all'intestino (GALT), regola equilibrio Th1/Th2/Th17/Treg, modula produzione di immunoglobuline secretorie. Alterazioni di queste funzioni nella disbiosi generano conseguenze sistemiche che si estendono ben oltre il tratto gastrointestinale.
🔬 Principali Funzioni del Microbiota Sano
- Metaboliche: Fermentazione fibre, sintesi vitamine K e B, produzione SCFA (butirrato, acetato, propionato)
- Protettive: Effetto barriera contro patogeni, competizione per nutrienti, produzione sostanze antimicrobiche
- Immunitarie: Maturazione sistema immunitario, modulazione risposta infiammatoria, tolleranza immunologica
- Strutturali: Mantenimento integrità mucosa intestinale, stimolazione turnover cellulare epiteliale
- Neuroendocrine: Produzione neurotrasmettitori (serotonina, GABA), modulazione asse intestino-cervello
Eubiosi vs disbiosi: l'equilibrio perduto
L'eubiosi definisce lo stato di equilibrio ottimale del microbiota intestinale, caratterizzato da diversità elevata, stabilità composizionale, predominanza di specie commensali e simbiotiche, capacità di resilienza dopo perturbazioni. In eubiosi, il microbiota svolge efficacemente le funzioni metaboliche, protettive e immunomodulatorie precedentemente descritte. Il rapporto Firmicutes/Bacteroidetes si mantiene in range fisiologico, la presenza di batteri produttori di butirrato (Faecalibacterium prausnitzii, Roseburia spp., Eubacterium spp.) risulta abbondante, la diversità alfa (numero di specie diverse) e beta (variabilità composizionale) sono elevate. La disbiosi, al contrario, rappresenta alterazione qualitativa e quantitativa della composizione microbica che compromette queste funzioni benefiche. Si manifesta attraverso riduzione della biodiversità (oligobiosi), diminuzione di specie benefiche, incremento di patobionti potenziali (microrganismi che in condizioni normali sono innocui ma possono diventare patogeni), instabilità composizionale con ridotta resilienza. La disbiosi non costituisce diagnosi specifica ma piuttosto condizione disregolatoria che può predisporre o accompagnare molteplici patologie. Esistono diversi pattern disbiotici: disbiosi putrefattiva (aumento proteolisi, produzione metaboliti tossici), fermentativa (fermentazione eccessiva carboidrati con produzione gas), deficitaria (insufficiente presenza di specie benefiche), sensibilizzazione (iperattivazione immunitaria verso commensali). La transizione da eubiosi a disbiosi raramente è evento acuto ma processo graduale innescato da fattori ambientali, dietetici, farmacologici o patologici che erodono progressivamente resilienza e funzionalità dell'ecosistema microbico.
⚖️ Eubiosi vs Disbiosi: Confronto Diretto
EUBIOSI (equilibrio): Alta diversità microbica, predominanza Bacteroidetes/Firmicutes bilanciati, abbondanza produttori butirrato, barriera intestinale integra, infiammazione minima, metabolismo efficiente
DISBIOSI (squilibrio): Bassa diversità, alterazione rapporto Firmicutes/Bacteroidetes, riduzione produttori SCFA, aumento patobionti, permeabilità intestinale aumentata, infiammazione cronica, metabolismo compromesso
Cause e Manifestazioni della Disbiosi
Fattori scatenanti della disbiosi intestinale
Molteplici fattori possono perturbare l'equilibrio del microbiota intestinale, spesso agendo sinergicamente. L'utilizzo di antibiotici rappresenta probabilmente la causa iatrogena più comune e devastante: gli antibiotici ad ampio spettro decimano indiscriminatamente popolazioni batteriche benefiche insieme ai patogeni target, riducendo drasticamente diversità microbica. Questa perturbazione può persistere per mesi o anni dopo cessazione del trattamento, particolarmente se ripetuto. La dieta occidentale, caratterizzata da elevato contenuto di zuccheri raffinati, grassi saturi, proteine animali e carenza di fibre, promuove crescita di patobionti come Proteobacteria e riduce specie benefiche fibrolipotiche. L'intake insufficiente di fibre priva il microbiota del substrato fermentativo essenziale. Gli edulcoranti artificiali (saccarina, sucralosio, aspartame) alterano composizione microbica e inducono intolleranza glucidica. Lo stress psicofisico cronico modifica motilità intestinale, secrezione acida, permeabilità epiteliale e asse ipotalamo-ipofisi-surrene, con ripercussioni dirette sul microbiota attraverso l'asse cervello-intestino bidirezionale. L'uso di farmaci non antibiotici (inibitori pompa protonica, metformina, FANS, contraccettivi orali) influenza ambiente intestinale e composizione microbica. Fattori ambientali come inquinamento, esposizione a pesticidi, metalli pesanti esercitano effetti perturbativi. Il parto cesareo e l'assenza di allattamento al seno durante l'infanzia compromettono colonizzazione iniziale ottimale. Infezioni gastrointestinali acute, anche quando risolte clinicamente, possono lasciare alterazioni microbiche persistenti. L'età avanzata si associa naturalmente a riduzione di diversità e shift composizionale sfavorevole. L'attività fisica insufficiente correla con minore biodiversità microbica. Comprendere questi fattori causali risulta essenziale per strategie preventive e terapeutiche mirate.
⚠️ Principali Cause di Disbiosi
Farmaci: Antibiotici (causa #1), IPP, FANS, lassativi, contraccettivi
Dieta: Eccesso zuccheri/grassi saturi, carenza fibre, edulcoranti artificiali, alcol
Stile di vita: Stress cronico, sonno insufficiente, sedentarietà, fumo
Ambientali: Inquinanti, pesticidi, metalli pesanti, mancanza esposizione natura
Patologie: Infezioni GI, malattie infiammatorie, diabete, obesità
Altri: Parto cesareo, assenza allattamento, invecchiamento
Sintomatologia gastrointestinale e sistemica
Le manifestazioni cliniche della disbiosi intestinale si estendono ben oltre il tratto gastrointestinale, riflettendo l'influenza sistemica del microbiota alterato. I sintomi gastrointestinali includono gonfiore addominale persistente, distensione, meteorismo, alterazioni dell'alvo con tendenza a diarrea, stipsi o alternanza delle due, dolore addominale crampiforme, dispepsia, nausea, sensazione di evacuazione incompleta. Questi sintomi derivano da fermentazione eccessiva o inadeguata, produzione abnorme di gas (idrogeno, metano, idrogeno solforato), alterata motilità, ipersensibilità viscerale. Le manifestazioni sistemiche riflettono la natura pervasiva delle ripercussioni disbiotiche: affaticamento cronico e ridotta energia, difficoltà concentrazione e brain fog, alterazioni dell'umore con ansia e depressione (asse microbiota-intestino-cervello), cefalee ricorrenti, dolori articolari e muscolari, manifestazioni dermatologiche (acne, eczema, psoriasi, rosacea), infezioni ricorrenti da immunodepressione, intolleranze alimentari progressive, carenze nutrizionali da malassorbimento. Le donne possono manifestare candidosi vulvovaginale recidivante e disturbi del ciclo mestruale. L'intensità sintomatica varia sostanzialmente tra individui in funzione di severità della disbiosi, sensibilità intestinale individuale, comorbidità presenti. Alcuni soggetti presentano disbiosi asintomatica identificabile solo attraverso analisi di laboratorio, mentre altri sviluppano sintomatologia severa invalidante. La sovrapposizione sintomatica con altre patologie gastrointestinali funzionali e organiche rende la diagnosi differenziale impegnativa, richiedendo valutazione clinica approfondita e spesso testing microbiologico specifico.
Disbiosi e patologie correlate
La disbiosi intestinale non costituisce entità patologica isolata ma si associa causalmente o conseguenzialmente a numerose condizioni cliniche. Le malattie infiammatorie intestinali (IBD) – morbo di Crohn e colite ulcerosa – presentano alterazioni microbiche caratteristiche con riduzione di F. prausnitzii e incremento di Escherichia coli aderente-invasiva. La sindrome dell'intestino irritabile (IBS) correla fortemente con disbiosi, particolarmente nei sottotipi IBS-D (diarrea predominante) e IBS-M (misto). Il sovrappeso e l'obesità si associano a riduzione di diversità microbica, alterato rapporto Firmicutes/Bacteroidetes, ridotta produzione di SCFA. Il microbiota disbiotico estrae più energia dagli alimenti, produce metaboliti che favoriscono adipogenesi, induce infiammazione sistemica di basso grado (endotossiemia metabolica) che perpetua insulino-resistenza. Il diabete tipo 2 presenta disbiosi caratterizzata da riduzione di produttori di butirrato e incremento di specie pro-infiammatorie. Le malattie cardiovascolari correlano con disbiosi attraverso produzione di trimetilammina-N-ossido (TMAO) da metabolismo microbico di carnitina e colina, composto aterogeno. Le patologie epatiche – steatosi epatica non alcolica (NAFLD), steatoepatite (NASH), cirrosi – presentano alterazioni microbiche che contribuiscono a endotossiemia e infiammazione epatica. Le allergie e malattie autoimmuni (artrite reumatoide, sclerosi multipla, lupus, tiroidite) si associano a disbiosi che compromette tolleranza immunologica. I disturbi neuropsichiatrici – depressione, ansia, autismo, malattia di Parkinson – mostrano correlazioni con alterazioni del microbiota attraverso l'asse intestino-cervello. Le neoplasie, particolarmente colon-rettali, correlano con specifici pattern disbiotici. Questa rete di associazioni evidenzia il ruolo centrale del microbiota nella fisiopatologia di condizioni apparentemente distanti dal tratto gastrointestinale.
🏥 Patologie Associate a Disbiosi
- Gastrointestinali: IBS, IBD (Crohn, colite ulcerosa), SIBO, celiachia, diverticolite
- Metaboliche: Obesità, diabete tipo 2, sindrome metabolica, NAFLD
- Autoimmuni: Artrite reumatoide, tiroidite Hashimoto, lupus, sclerosi multipla
- Neurologiche: Depressione, ansia, autismo, Parkinson, Alzheimer
- Dermatologiche: Acne, eczema, psoriasi, rosacea, dermatite atopica
- Cardiovascolari: Aterosclerosi, ipertensione, scompenso cardiaco
- Allergiche: Asma, rinite allergica, allergie alimentari
Sospetti di Avere una Disbiosi Intestinale?
Scopri come posso aiutarti a ripristinare l'equilibrio del tuo microbiota attraverso un approccio personalizzato
Prenota una ConsulenzaDiagnosi e Valutazione
Test diagnostici per la disbiosi
La valutazione della disbiosi intestinale si avvale di diverse metodologie diagnostiche, ciascuna con specifici vantaggi e limitazioni. L'analisi del microbiota fecale mediante sequenziamento del gene 16S rRNA o metagenomica shotgun rappresenta il gold standard attuale. Questa tecnologia identifica e quantifica le specie microbiche presenti, fornendo profilo composizionale dettagliato, indici di diversità alfa e beta, rapporti tra phyla principali, presenza/assenza di specie chiave. Il sequenziamento 16S analizza regioni conservate del DNA batterico permettendo identificazione tassonomica fino al genere o specie. La metagenomica shotgun sequenzia l'intero DNA microbico fornendo informazioni anche su funghi, virus, parassiti e capacità funzionali del microbiota. Il test del respiro (breath test) valuta sovracrescita batterica del piccolo intestino (SIBO) misurando produzione di idrogeno e metano dopo somministrazione di substrati specifici (glucosio o lattulosio). Elevazioni precoci indicano fermentazione batterica anomala nel tenue. L'analisi metabolomica fecale quantifica metaboliti microbici chiave: acidi grassi a catena corta (butirrato, acetato, propionato), acidi biliari secondari, indoli, fenoli. Ridotti livelli di SCFA suggeriscono compromissione fermentativa. Il dosaggio di marcatori infiammatori fecali come calprotectina e lattoferrina identifica infiammazione intestinale associata a disbiosi severa. Gli esami ematici possono rivelare conseguenze sistemiche: carenze nutrizionali (vitamina D, B12, ferro, zinco), markers infiammatori elevati (PCR, omocisteina), endotossiemia (LPS circolante), permeabilità intestinale aumentata (zonulina). La valutazione clinica attraverso questionari validati (questionario sintomatologico gastrointestinale, scale di Bristol per consistenza fecale) complementa i test di laboratorio. La scelta dei test appropriati dovrebbe essere guidata da presentazione clinica, sospetto diagnostico e obiettivi terapeutici.

Interpretazione dell'analisi del microbiota
L'interpretazione dei risultati dell'analisi del microbiota richiede competenza specialistica e considerazione del contesto clinico. I parametri chiave da valutare includono la diversità alfa (ricchezza e uniformità di specie nell'ecosistema individuale): valori ridotti indicano oligobiosi e correlano con multiple patologie. L'indice di Shannon e il numero di specie osservate quantificano questa diversità. Il rapporto Firmicutes/Bacteroidetes fornisce indicazioni metaboliche: incremento eccessivo (>10:1) si associa a obesità ed estrazione energetica aumentata, mentre riduzione marcata può indicare malnutrizione o malassorbimento. L'abbondanza di specie benefiche chiave rivela funzionalità dell'ecosistema: Faecalibacterium prausnitzii (produttore principale di butirrato, anti-infiammatorio), Akkermansia muciniphila (rinforza barriera intestinale, migliora metabolismo), Bifidobacterium spp. (protettivo, immunomodulante), Lactobacillus spp. (produttore acido lattico, antimicrobico). La presenza di patobionti potenziali richiede attenzione: incremento di Proteobacteria (particolarmente Enterobacteriaceae), Desulfovibrio (produttore idrogeno solforato tossico), Clostridium difficile, Candida spp. La valutazione degli enterotipi (cluster composizionali dominanti) può guidare raccomandazioni dietetiche personalizzate. L'analisi dei pathway metabolici predice capacità funzionali: biosintesi vitamine, produzione SCFA, metabolismo aminoacidi, degradazione xenobiotici. Crucialmente, l'interpretazione deve contestualizzare i risultati rispetto a sintomatologia clinica, storia medica, fattori dietetici e lifestyle. Pattern disbiotici simili possono generare manifestazioni cliniche differenti in individui diversi. L'obiettivo non è ripristinare composizione "normale" ideale (che non esiste universalmente) ma migliorare funzionalità microbica e sintomatologia del paziente.
📊 Parametri Chiave nell'Analisi del Microbiota
DIVERSITÀ ALFA (Indice Shannon):
• Ottimale: >3.5 | Ridotta: 2-3 | Severa oligobiosi: <2
RAPPORTO FIRMICUTES/BACTEROIDETES:
• Bilanciato: 1:1 - 3:1 | Elevato (>10:1): rischio obesità/metabolico
SPECIE BENEFICHE DA MONITORARE:
• F. prausnitzii (>5% popolazione): anti-infiammatorio
• A. muciniphila (>1%): integrità barriera
• Bifidobacterium (>5%): protezione immunità
PATOBIONTI (idealmente <1%):
• Proteobacteria, Desulfovibrio, C. difficile, Candida
Strategie Terapeutiche
Approccio nutrizionale alla disbiosi
La modulazione dietetica rappresenta il pilastro fondamentale del trattamento della disbiosi, con potenziale di rimodellare profondamente composizione e funzionalità del microbiota. L'incremento dell'intake di fibre alimentari costituisce intervento primario: fibre solubili (pectine, inulina, beta-glucani) e insolubili (cellulosa, lignina) fungono da substrato fermentativo per batteri saccarolitici, stimolando produzione di SCFA benefici. L'obiettivo è raggiungere 25-35 grammi giornalieri da fonti vegetali diversificate: cereali integrali, legumi, verdure, frutta, semi. La diversificazione alimentare massimizza la biodiversità microbica: consumare >30 tipi di vegetali diversi settimanalmente correla con microbiota più ricco. Gli alimenti fermentati tradizionali forniscono batteri lattici benefici: yogurt non zuccherato, kefir, crauti non pastorizzati, kimchi, miso, tempeh, kombucha. Questi alimenti contengono microrganismi vivi (seppur transienti) e metaboliti bioattivi. I polifenoli alimentari da frutti di bosco, tè verde, cacao, olio extravergine d'oliva esercitano effetti prebiotici e anti-infiammatori, favorendo crescita di Akkermansia e Bifidobacterium. La riduzione di alimenti pro-disbiotici risulta parimenti cruciale: limitare zuccheri raffinati che alimentano patobionti, ridurre grassi saturi e trans, moderare proteine animali eccessive (particolarmente carni rosse processate), eliminare edulcoranti artificiali. Approcci dietetici specifici possono essere indicati: la dieta a basso contenuto di FODMAPs riduce temporaneamente substrati fermentativi alleviando sintomi in IBS, da seguire sotto supervisione per evitare restrizioni eccessive. La dieta mediterranea, ricca in vegetali, olio d'oliva, pesce, cereali integrali, si associa a microbiota favorevole con abbondanza di produttori di SCFA. Il timing dei pasti e il digiuno intermittente possono influenzare ritmi circadiani microbici e funzionalità metabolica. L'individualizzazione dell'approccio basata su composizione microbica, sintomi e tolleranze personali ottimizza risultati.
🥗 Alimenti Pro-Eubiosi vs Pro-Disbiosi
FAVORISCONO EUBIOSI (incrementare):
• Fibre: verdure, legumi, cereali integrali, frutta
• Fermentati: yogurt, kefir, crauti, kimchi, miso
• Polifenoli: frutti di bosco, tè verde, cacao, olio EVO
• Omega-3: pesce grasso, semi lino, noci
• Prebiotici: cipolle, aglio, porri, asparagi, banane
FAVORISCONO DISBIOSI (limitare):
• Zuccheri raffinati e dolcificanti artificiali
• Grassi saturi eccessivi, grassi trans
• Carni rosse processate frequenti
• Alcol eccessivo
• Alimenti ultraprocessati con additivi
Probiotici, prebiotici e postbiotici
L'integrazione mirata con modulatori del microbiota offre strumento terapeutico complementare alla dieta. I probiotici sono microrganismi vivi che, somministrati in quantità adeguate, conferiscono beneficio alla salute dell'ospite. I ceppi più studiati appartengono a Lactobacillus (L. rhamnosus, L. acidophilus, L. plantarum, L. casei) e Bifidobacterium (B. longum, B. breve, B. lactis). Saccharomyces boulardii, lievito probiotico, presenta efficacia particolare in diarrea associata ad antibiotici e C. difficile. I meccanismi d'azione includono competizione con patogeni, produzione di sostanze antimicrobiche, rafforzamento barriera intestinale, modulazione immunità. La scelta del ceppo dovrebbe basarsi su evidenze specifiche per la condizione target: alcuni ceppi mostrano efficacia in IBS, altri in diarrea, altri ancora in modulazione immunità. Il dosaggio critico è tipicamente 10⁹-10¹¹ CFU giornalieri. I prebiotici sono substrati selettivamente fermentati da microrganismi benefici che conferiscono vantaggio alla salute. Includono inulina, frutto-oligosaccaridi (FOS), galatto-oligosaccaridi (GOS), amido resistente. Stimolano crescita di Bifidobacterium e Lactobacillus, aumentano produzione di SCFA, migliorano assorbimento minerali. Fonti naturali includono cicoria, topinambur, aglio, cipolla, porri, asparagi, banane non mature. I simbiotici combinano probiotici e prebiotici sinergicamente. I postbiotici – metaboliti bioattivi prodotti da probiotici o presenti in alimenti fermentati – emergono come strategia innovativa: SCFA purificati, componenti della parete batterica, enzimi, vitamine. Offrono vantaggi senza necessità di viabilità microbica. La supplementazione dovrebbe essere personalizzata, temporizzata (preferibilmente lontano da antibiotici se prescritti), continuata per periodi adeguati (minimo 4-8 settimane) e rivalutata in base a risposta clinica.
💊 Guida Pratica a Probiotici e Prebiotici
PROBIOTICI - Ceppi Specifici per Condizione:
• IBS/gonfiore: B. infantis 35624, L. plantarum 299v
• Diarrea antibiotici: S. boulardii, L. rhamnosus GG
• Stipsi: B. lactis BB-12, L. casei Shirota
• Immunità: L. rhamnosus GR-1, B. longum BB536
• Dosaggio: minimo 10 miliardi CFU/die
• Durata: 4-12 settimane minimo
PREBIOTICI - Fonti e Dosaggio:
• Inulina/FOS: 5-10g/die (cicoria, topinambur, aglio)
• GOS: 3-5g/die (legumi, latte materno)
• Amido resistente: 15-20g/die (patate fredde, banana verde)
• Pectina: frutta (mele, agrumi, bacche)
Modifiche dello stile di vita
Fattori lifestyle esercitano influenza profonda sulla composizione e funzionalità del microbiota intestinale, spesso sottovalutata rispetto agli interventi dietetici e farmacologici. L'esercizio fisico regolare incrementa diversità microbica, aumenta abbondanza di produttori di butirrato, riduce infiammazione sistemica indipendentemente da perdita ponderale. L'attività aerobica moderata (150-300 minuti settimanali) e resistenza combinati ottimizzano benefici. La gestione dello stress risulta cruciale: lo stress cronico altera motilità intestinale, permeabilità epiteliale, secrezione neuroendocrina attraverso l'asse ipotalamo-ipofisi-surrene, con ripercussioni dirette sul microbiota. Tecniche di riduzione stress – mindfulness, meditazione, yoga, respirazione diaframmatica, supporto psicologico – migliorano sintomi gastrointestinali e parametri microbici. Il sonno adeguato (7-9 ore notturne) mantiene ritmi circadiani del microbiota; la deprivazione di sonno altera composizione microbica favorendo disbiosi. L'esposizione alla natura e ambienti biodiversi arricchisce il microbiota attraverso contatto con microrganismi ambientali. La convivenza con animali domestici, giardinaggio, tempo trascorso in parchi aumentano diversità microbica. La riduzione di xenobiotici – pesticidi, antibiotici non essenziali, farmaci quando possibile (sotto supervisione medica) – previene perturbazioni iatrogene. L'igiene equilibrata evita sia esposizione eccessiva a patogeni sia sterilizzazione eccessiva che compromette educazione immunità. Il supporto sociale e relazioni interpersonali positive correlano con microbiota più sano attraverso meccanismi neuroendocrini e comportamentali. La cessazione del fumo migliora composizione microbica e riduce infiammazione intestinale. La moderazione alcolica (preferibilmente eliminazione) previene disbiosi e permeabilità intestinale aumentata. Questi interventi lifestyle, sebbene richiedano impegno a lungo termine, generano benefici sinergici che trascendono il microbiota, migliorando salute olistica.

Prevenzione e Mantenimento
Costruire un microbiota resiliente
La resilienza microbica definisce la capacità dell'ecosistema intestinale di resistere a perturbazioni e recuperare rapidamente composizione e funzionalità pre-disturbo. Costruire resilienza costituisce obiettivo preventivo fondamentale superiore al semplice trattamento della disbiosi manifesta. La diversità elevata rappresenta fondamento della resilienza: ecosistemi biodiversi possiedono ridondanza funzionale dove molteplici specie possono compensare perdita di altre, mantenendo funzioni essenziali. Consumare varietà alimentare ampia, particolarmente vegetali diversificati, incrementa biodiversità. L'esposizione microbica appropriata durante infanzia – parto vaginale, allattamento al seno, contatto con natura e animali, evitamento antibiotici non essenziali – stabilisce fondamenta robuste. Negli adulti, mantenere dieta ricca in fibre costantemente nutre comunità microbiche saccarolitiche benefiche. La minimizzazione di fattori perturbativi – uso giudizioso antibiotici solo quando necessari, riduzione stress cronico, sonno adeguato, limitazione alcol – preserva stabilità. L'integrazione periodica con probiotici e prebiotici durante fasi di stress (viaggi, cambi stagionali, periodi lavorativi intensi) può supportare resilienza. Il monitoraggio proattivo di sintomi emergenti permette intervento precoce prima che disbiosi diventi severa e radicata. La costruzione di abitudini sostenibili piuttosto che interventi drastici temporanei assicura mantenimento a lungo termine. L'educazione continua sulla salute intestinale e microbiota empowera scelte informate. La resilienza microbica si costruisce quotidianamente attraverso decisioni cumulative che favoriscono eubiosi: ogni pasto, ogni notte di sonno, ogni sessione di movimento rappresenta opportunità di nutrire e proteggere questo ecosistema vitale che sostiene la nostra salute.
Monitoraggio a lungo termine
Il mantenimento dell'eubiosi richiede vigilanza continuata e adattamenti periodici basati su feedback clinici e, quando indicato, laboratoristici. Il monitoraggio sintomatologico attraverso diario alimentare e dei sintomi identifica pattern, trigger dietetici, correlazioni tra comportamenti e benessere intestinale. Valutare regolarmente parametri come frequenza evacuazioni, consistenza fecale (scala Bristol), gonfiore, dolore, energia generale fornisce feedback immediato sull'efficacia degli interventi. Le ri-analisi periodiche del microbiota (ogni 6-12 mesi) quantificano oggettivamente cambiamenti composizionali e funzionali, permettendo aggiustamenti terapeutici mirati. Particolare attenzione durante transizioni critiche: post-antibiotici, cambio stagionale, variazioni dietetiche significative, periodi stress elevato. Il mantenimento di abitudini protettive anche dopo miglioramento sintomatologico previene recidive: continuare intake elevato fibre, probiotici ciclici, gestione stress, attività fisica. La flessibilità adattativa riconosce che il microbiota cambia fisiologicamente con età, stagioni, circostanze; l'obiettivo non è rigidità ma mantenimento di funzionalità e diversità adeguate. Il supporto professionale continuativo – consultazioni periodiche con nutrizionista specializzato in salute intestinale – guida aggiustamenti personalizzati e previene deriva verso vecchie abitudini disbiotiche. La costruzione di comunità di supporto – gruppi, forum, risorse educative – rafforza motivazione e condivisione esperienze. Crucialmente, sviluppare autocompassione riconoscendo che perfezionismo risulta controproducente; occasionali deviazioni non demoliscono microbiota resiliente. L'approccio a lungo termine enfatizza progressi sostenibili piuttosto che risultati rapidi e fragili, coltivando relazione armoniosa con il proprio ecosistema intestinale che evolve e si adatta insieme all'ospite attraverso le fasi della vita.
🔄 Quando Rivalutare il Microbiota
Situazioni che richiedono nuova valutazione:
• Persistenza sintomi nonostante 3-6 mesi trattamento
• Nuovo ciclo antibiotici (rivalutare 4-8 settimane dopo)
• Ricomparsa sintomi dopo periodo di benessere
• Nuove diagnosi mediche rilevanti
• Cambiamenti dietetici maggiori pianificati
• Preparazione a interventi chirurgici
• Pianificazione gravidanza
• Controllo periodico (ogni 12 mesi) per condizioni croniche
Conclusione
La disbiosi intestinale rappresenta condizione complessa e multifattoriale che riflette perturbazione dell'ecosistema microbico che risiede nel nostro tratto gastrointestinale. Lungi dall'essere fenomeno isolato, la disbiosi esercita ripercussioni sistemiche che si estendono a metabolismo, immunità, neurologia, dermatologia e oltre, evidenziando il ruolo centrale del microbiota come organo metabolico che influenza virtualmente ogni aspetto della fisiologia umana.
La comprensione crescente dell'asse microbiota-intestino-cervello e delle interconnessioni tra comunità microbica e salute dell'ospite ha trasformato radicalmente l'approccio terapeutico. Non si tratta più semplicemente di eradicare patogeni ma di ripristinare equilibrio ecologico, nutrire diversità, supportare funzionalità. Questo paradigma shift enfatizza strategie olistiche che integrano nutrizione, supplementazione mirata, modifiche lifestyle e gestione stress.
L'approccio nutrizionale emerge come pilastro fondamentale: l'incremento di fibre alimentari diversificate, l'incorporazione di alimenti fermentati tradizionali, la ricchezza di polifenoli, l'eliminazione di alimenti pro-disbiotici creano ambiente favorevole a eubiosi. La dieta non è semplicemente carburante ma informazione che comunica continuamente con il microbiota, modellando composizione e funzione.
L'integrazione intelligente con probiotici strain-specific, prebiotici mirati e postbiotici emergenti offre strumenti terapeutici potenti quando personalizzati in base a profilo microbico e sintomatologia individuale. Tuttavia, questi interventi supplementari potenziano ma non sostituiscono fondamenta dietetiche e lifestyle solide.
La diagnosi attraverso tecnologie avanzate di sequenziamento microbico permette valutazione oggettiva dello stato disbiotico e monitoraggio dell'efficacia terapeutica. L'interpretazione contestualizzata dei risultati guida personalizzazione degli interventi, riconoscendo che non esiste composizione "ideale" universale ma piuttosto configurazioni funzionali che variano tra individui.
La resilienza microbica – costruita attraverso diversità, esposizione appropriata, nutrizione consistente, minimizzazione di perturbazioni – rappresenta obiettivo preventivo superiore al trattamento reattivo della disbiosi manifesta. Investire nella salute intestinale quotidianamente attraverso scelte alimentari consapevoli, gestione stress, movimento regolare, sonno adeguato costituisce medicina preventiva più potente.
Il viaggio verso eubiosi richiede pazienza, consistenza e prospettiva a lungo termine. Il microbiota non si trasforma istantaneamente ma risponde gradualmente a segnali ambientali persistenti. Ogni pasto rappresenta opportunità di nutrire comunità microbiche benefiche; ogni notte di riposo permette rigenerazione e riparazione; ogni momento di stress gestito protegge delicato equilibrio intestinale.
Crucialmente, l'approccio alla disbiosi deve trascendere il riduzionismo sintomatico per abbracciare visione olistica che riconosce interconnessione tra intestino, cervello, sistema immunitario, metabolismo. I sintomi gastrointestinali rappresentano spesso manifestazione superficiale di squilibri più profondi che richiedono indagine e trattamento multimodale.
La medicina moderna riconosce crescentemente che noi non siamo entità biologiche isolate ma ecosistemi viventi in cui cellule umane e microbiche coesistono simbioticamente. Prendersi cura del microbiota significa prendersi cura di sé stessi a livello fondamentale. Questo shift percettivo da "combattere batteri" a "coltivare ecosistema interno sano" rappresenta evoluzione paradigmatica nella comprensione della salute umana.
Il futuro della medicina personalizzata incorporerà sempre più profondamente l'analisi del microbiota per predire rischi patologici, personalizzare interventi terapeutici, monitorare risposta a trattamenti. La ricerca emergente su trapianto di microbiota fecale, batterioterapie mirate, modulazione metabolomica promette strumenti terapeutici ancora più sofisticati.
Per il momento presente, gli strumenti a nostra disposizione – dieta sapiente, integrazione strategica, lifestyle consapevole – offrono potenziale straordinario di trasformazione quando applicati con consistenza e competenza. La disbiosi non è condanna permanente ma invito a riequilibrare relazione con il proprio ecosistema interno attraverso scelte quotidiane che onorano complessità e saggezza della biologia microbica.
🌟 Principi Chiave per Microbiota Sano
- Diversità: Consumare >30 tipi vegetali diversi settimanalmente
- Fibre: 25-35g giornalieri da fonti variegate
- Fermentati: Incorporare quotidianamente alimenti probiotici naturali
- Polifenoli: Colorare il piatto con vegetali ricchi antiossidanti
- Movimento: 150+ minuti attività aerobica settimanale
- Stress: Pratiche quotidiane gestione stress (meditazione, yoga)
- Sonno: 7-9 ore qualità notturna costante
- Antibiotici: Uso giudizioso solo quando strettamente necessari
- Natura: Esposizione regolare ambienti biodiversi
- Comunità: Coltivare relazioni supportive positive
In conclusione, la salute intestinale e l'equilibrio del microbiota rappresentano fondamenta su cui si costruisce benessere sistemico. Investire tempo, attenzione e risorse nella cura di questo ecosistema interno non è vanità o ossessione ma saggezza biologica profonda. Il microbiota ci ha accompagnato evolutivamente per milioni di anni; ignorarne importanza o perturbarlo inconsapevolmente genera conseguenze che si manifestano attraverso sintomi gastrointestinali, metabolici, immunitari, neurologici.
Ripristinare eubiosi e mantenerla rappresenta processo continuo di apprendimento, adattamento e ascolto del proprio corpo. Non esistono soluzioni miracolose o protocolli universali ma principi fondamentali – diversità, fibre, fermentati, movimento, riposo, gestione stress – che applicati consistentemente trasformano gradualmente composizione e funzionalità microbica.
Il potere di influenzare positivamente il proprio microbiota risiede principalmente nelle scelte quotidiane: cosa mettiamo nel piatto, come gestiamo tensioni emotive, quanto ci muoviamo, come dormiamo. Questa autonomia terapeutica empowera prendersi responsabilità attiva della propria salute intestinale piuttosto che dipendere esclusivamente da interventi farmacologici esterni.
L'intestino sano è fondamento di vita sana. Coltivare eubiosi attraverso nutrizione sapiente, supplementazione strategica, lifestyle consapevole non è compito che si completa ma pratica che si perfeziona continuamente. Ogni giorno offre opportunità di nutrire, proteggere e onorare la comunità microbica che ci sostiene silenziosamente, influenzando salute fisica, mentale ed emotiva in modi che stiamo solo iniziando a comprendere pienamente.
Vuoi Ripristinare l'Equilibrio del Tuo Microbiota?
Offro consulenze specializzate per valutazione e trattamento personalizzato della disbiosi intestinale
Prenota la Tua Consulenza